
手机扫码访问本站

微信咨询
分裂、传代和亚培养都是维持健康细胞培养细胞的重要过程。本文将为您提供有关如何传代细胞、传代细胞步骤以及可能出现的问题的详细指出。
在深入研究如何传代细胞之前,我们需要解释一下粘附细胞和悬浮细胞之间的区别。
贴壁细胞附着在培养瓶和培养皿的表面。这意味着它们的生长受到培养皿或培养瓶表面面积的限制。这也意味着需要先将它们分离,然后才能将它们重新接种到新的培养皿中。
细胞培养板和培养瓶通常会经过涂层处理,以帮助促进细胞附着在表面。
悬浮细胞不附着,而是自由漂浮在培养基中。因此,它们的生长不受表面积的限制,而是受培养物中细胞密度的限制。悬浮细胞需要搅拌以确保最佳生长和气体交换,通常在旋转瓶或摇动培养箱中生长。
由于悬浮细胞不需要从培养瓶中分离出来,因此它们被认为更易于传代。
表1.悬浮细胞与贴壁细胞的比较:
| 悬浮细胞 | 贴壁 |
|
更容易培养,无需去除所有旧培养基即可稀释。 |
需要更多步骤进行传代,需要定期彻底更换培养基。 |
| 不需要机械或化学解离 | 需要用胰蛋白酶消化才能传代培养,这会给细胞带来压力 |
| 不容易确定汇合度需要每日进行细胞计数 | 可以在显微镜下轻松检查以确定汇合度 |
| 细胞浓度限制生长 | 生长受表面积限制 |
您已检查细胞培养物的融合度,并且它们已准备好传代。接下来该做什么?传代贴壁细胞主要有四个步骤:
一、PBS洗涤
在从培养皿中分离细胞之前,重要的是吸出旧的、用过的培养基并用平衡盐溶液(BSS)冲洗细胞。
为什么需要冲洗贴壁细胞?
冲洗细胞将有助于消除培养基中可能抑制细胞释放溶液作用的蛋白质和离子。使用BSS是因为它们能保持生理pH值和盐浓度。
典型的盐溶液包括:
·磷酸盐缓冲溶液(PBS)
·汉克斯缓冲盐溶液(HBSS)
·Earle平衡盐溶液(EBSS)
在传代培养细胞时应使用不含钙和镁的盐溶液,因为钙和镁都会促进细胞聚集。
二、消化/解离
通过破坏细胞蛋白与培养皿表面的相互作用,细胞可以从培养皿中释放出来。不同类型的细胞在粘附培养皿底部方面具有不同的特性。一些细胞仍然像小球一样,几乎不与培养皿接触,而另一些细胞则平铺并覆盖多层蛋白质,将它们与培养皿结合在一起。
您的目标是使用对每种细胞类型损伤最小的程序将细胞从培养皿中分离出来。您选择如何将细胞从培养皿中释放出来将取决于细胞的粘附特性。
选择1:机械分离
一些轻度粘附的细胞在加入BSS(不含钙和镁)后会开始从培养皿中升起。在这种情况下,只需将BSS直接喷洒在细胞上并轻敲培养皿即可去除细胞。
也可以用细胞刮刀轻轻去除松散附着的细胞。
选择2:EDTA
EDTA是一种螯合剂,可以结合整合素维持细胞粘附所需的Ca 2+离子。EDTA(1-10mM,取决于细胞类型)是将细胞从培养皿中分离出来的较温和的方法之一,但仅使用EDTA对大多数细胞类型来说不够有效。
EDTA在预热至37°C时最有效,但对于非常敏感的细胞,请使用室温或4°C的EDTA。
选择3:酶促释放
蛋白水解酶可用于消化粘附细胞到培养皿的蛋白质。此选项对于传递牢固附着的粘附细胞是必需的,因此通常用于传递粘附细胞。
然而,需要谨慎,因为蛋白水解消化可能会通过切割细胞表面蛋白来破坏细胞的完整性。治疗时间应限制在刚好达到细胞分离所需的时间范围内,以防止细胞损伤。
对于处理细胞的时间长短没有硬性规定。处理时间需要根据每种细胞类型根据经验确定,取决于细胞粘附的强度、细胞培养的时间长度以及培养物的汇合度。
胰蛋白酶是用于传代细胞的最常用酶。胰蛋白酶在赖氨酸或精氨酸残基后进行切割,而脯氨酸不会紧随其后。工作胰蛋白酶浓度范围为0.025%至0.5%,胰蛋白酶溶液通常用EDTA制成,以增强细胞分离。
3.分离和灭活
为了防止细胞结块和分布不均,细胞应处于单细胞悬浮状态。如果不是,向细胞中添加少量液体,然后轻轻地将液体移入和移出5毫升移液器。
有些实验室会添加加热的生长培养基,而有些实验室会添加含有10%胎牛血清(FBS)的BSS。添加加热的生长培养基或BSS+FBS可使用于从培养皿中分离细胞的试剂失活,并提供更多体积用于移液。
为了完全灭活分离剂,请将细胞收集到大量生长培养基或BSS+FBS中,然后离心细胞。如果将细胞稀释到大量生长培养基中以便重新接种,并且残留的胰蛋白酶/EDTA不会影响细胞附着,则可以省略离心步骤。
4、接种
当细胞从培养皿中脱落或处于离心机中时,我通常会设置要将细胞移入的培养皿,标记所需数量的培养皿,并将加热的生长培养基添加到培养皿中。
细胞分离后,将离心后的细胞重新悬浮在少量生长培养基中,并使用血细胞计数器计数细胞。将细胞稀释至适当密度,然后分装到新培养皿中。我喜欢添加足够的培养基,将1-2毫升移液到每个接收培养皿中。轻轻旋转和摇动培养皿,使细胞均匀分散在整个培养皿中。
一些细胞,例如我们血液中的造血细胞,自然地悬浮在体液中,不会附着在表面。
培养这些悬浮细胞比培养贴壁细胞要容易一些,因为悬浮细胞不需要胰蛋白酶消化,因为它们已经是自由漂浮的。因此,传代过程更快,对细胞的压力更小。
确定悬浮细胞的传代时间
悬浮细胞通常保存在培养瓶中,每2或3天达到汇合时重新接种。您可以判断悬浮细胞何时达到汇合,因为它们会开始聚集在一起并漂浮在培养基上;培养基会略微改变颜色并显得更浑浊。
悬浮细胞传代涉及两个主要步骤:
然而,如果细胞已达到高密度且培养基变酸,您可能希望通过添加离心步骤去除旧培养基。
在分离细胞之前,您应该在倒置相差显微镜下观察培养物。健康生长的悬浮细胞应呈圆形且明亮,细胞碎片最少。通过观察颜色来检查培养基是否呈酸性:当pH值为酸性时,酚红会变黄,这表明培养物中的细胞过多。
1.计数细胞
悬浮细胞通常保存在培养瓶中,每2或3天达到汇合时重新接种。如果您正在准备用于实验的培养瓶,您可能需要先计算细胞数量,以确保您在培养瓶中接种了适当数量的细胞。
计数悬浮细胞与计数粘附细胞相同(在它们分离并重新悬浮之后)。但是,为了确保粘附细胞的计数准确,请在取样计数之前轻轻移液培养物,以确保培养物分布均匀。
如果您正在分裂细胞以进行维护,则可以跳过计数步骤。
2.稀释细胞
对于悬浮细胞,并不需要像贴壁细胞那样真正去除所有旧培养基。相反,可以去除部分旧培养物,然后用新鲜培养基将剩余的培养物稀释到合适的细胞密度。
或者,可以从旧烧瓶中取出一部分细胞并稀释到新鲜培养基中。
但是,当您的培养物呈酸性时,建议移除培养基。要移除旧培养基,请以150xg离心5分钟,移除酸性培养基,轻轻地将细胞沉淀悬浮在温热培养基中,然后重新接种到新鲜培养基中。
1.使用前将所有试剂放入37°C水浴中预热约30分钟。这将有助于保持细胞健康并避免温度变化带来的冲击。
2.在开始之前设置组织培养罩,确保罩是干净的,并且您拥有所需的所有设备。这可以缩短传代细胞所需的时间,并减少因离开培养罩/培养室而造成的潜在污染。
3.在组织培养罩内设立不同的“洁净区”和“脏区”,并合理设置它们,这样您就不会将脏设备放在“洁净区”内。
4.确保始终使用无菌技术,以尽量减少细胞的潜在污染。将试剂从水浴中取出后,不要忘记擦拭试剂,并在将其放入通风柜前用70%乙醇或IMS喷洒试剂。
5.仅使用少量胰蛋白酶释放细胞(1-2ml/25cm2),并将胰蛋白酶时间保持在释放细胞所需的最短时间(当细胞刚刚检测到时)。用力“拍打”培养皿和烧瓶,以帮助在胰蛋白酶消化后释放细胞。
6.胰蛋白酶化后,向胰蛋白酶和细胞中添加少量加热的生长培养基,然后用5毫升移液器反复将液体移入和移出,以打碎任何细胞团块。
7.重新接种细胞(特别是贴壁细胞)时,轻轻摇晃/旋转培养板以确保细胞分布均匀。详情见下图1。
如何传代细胞:接种后获得均匀分布的细胞。
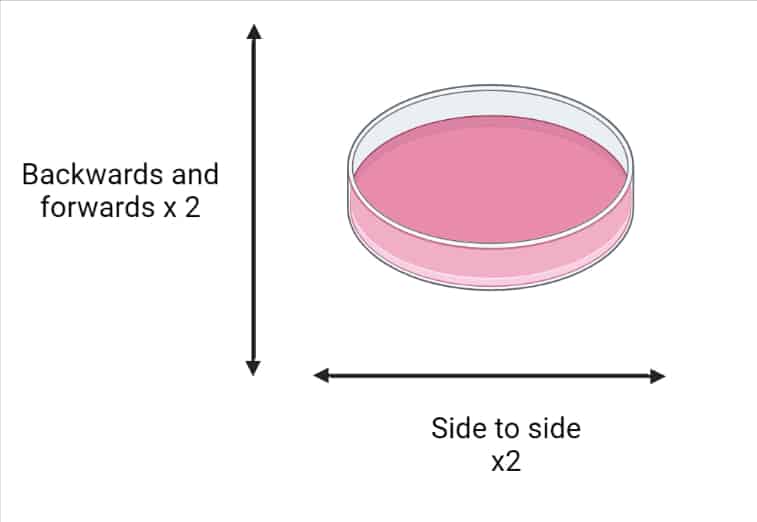
图1.接种后如何使细胞分布均匀。
8.开始前预先标记培养板,并在细胞进行胰蛋白酶消化时添加温热培养基。这可以最大限度地缩短细胞离开培养箱的时间,从而限制环境冲击和干扰的程度。
9.以1:2至1:10之间的稀释比例分批细胞。稀释比例过高,细胞很快就会变得过于拥挤;稀释比例过低,细胞可能因密度低而无法存活。(细胞也会感到孤独!)
10.为细胞分裂制定一个时间表(例如,在星期二和星期五)。制定时间表将使你更容易记住传代培养物,避免细胞过度融合。
11.整理好培养箱,这样你就能确切地知道哪些细胞在哪里。这可以减少你寻找培养物的时间。长时间打开培养箱门可能会改变环境,影响细胞的生长和正在进行的实验。
好了,上述是细胞传代概述,无论你培养哪种细胞类型,分裂细胞时都应准确、无菌且快速,以尽量减少污染和对培养物的压力。做好准备和组织起来也有助于缩短分裂细胞所需的时间。
 QQ:2881498722
QQ:2881498722  手机号码:15800441226
手机号码:15800441226 服务电话:021-54721350
服务电话:021-54721350 E-mail:2881498722@qq.com
E-mail:2881498722@qq.com 公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室
公司地址:上海市金山工业区亭卫公路6558号9幢2447-12室